Dit artikel is deel van de zonnebrandstoffen-special van het Nederlands Tijdschrift voor Natuurkunde.
De onderzoeksgroep Electrochemical Materials & Interfaces (EMI) van het Dutch Institute for Fundamental Energy Research (DIFFER) onderzoekt processen aan grensvlakken in foto-elektrochemische cellen. In zo’n cel wordt water omgezet in zuurstof en waterstof, waarbij zonlicht, en niet elektriciteit, de energiebron is. De grensvlakken hebben grote invloed op de efficiëntie. We vinden het grensvlak dat in contact staat met water het interessantst, want daar wordt water omgezet in zuurstof en waterstof. Door experimentele data te modeleren en te combineren met theoretische simulaties, proberen we te achterhalen welke processen ten grondslag liggen aan de trage zuurstofvorming om zo de efficiëntie van fotokatalytische (alsmede elektrolytische) waterstofproductie te verhogen en geschikt te maken voor commercieel gebruik.
De vooruitziende blik van Jules Verne
“Hoe zou het toch verder moeten als alle steenkool ooit op is. Wat zal men dan branden?” “Water”, antwoordt spoorwegingenieur Cyrus Harding. “De waterstof en de zuurstof, waaruit water bestaat, zullen een onuitputtelijke bron van warmte en licht vormen. [...] Water is de steenkool van de toekomst.” [1] Zo herkende Jules Verne al in 1874 de potentie van waterstof. Nu het einde van het fossiele brandstoftijdperk in zicht lijkt te zijn, komt de waterstofeconomie van Jules Verne steeds dichterbij.
Zonlicht opslaan in water
Waterstof kan gemaakt worden door water te splitsen onder invloed van elektrische stroom; dit proces noemen we elektrolyse. Wanneer we hiervoor duurzame energie gebruiken, is dit een duurzame manier van waterstof produceren. In een brandstofcel kunnen waterstof en zuurstof weer worden omgezet in elektriciteit, met als restproduct water. Op deze wijze kunnen we energie opslaan, of gebruiken, in de vorm van chemische bindingen en bijvoorbeeld de fluctuaties in duurzame elektriciteitsopwekking opvangen.
Eind jaren 60 demonstreerde Akari Fujishima dat zonlicht ook direct gebruikt kan worden om waterstof te maken uit water, i.p.v. zonlicht eerst om te zetten in elektriciteit met zonnecellen en dan via elektrolyse waterstof te maken. Dit proces heet fotokatalytische waterstofproductie en gebeurt in een foto-elektrochemische cel. De werking van zo’n cel staat uitgelegd in kader I. Water wordt aan het elektrode-oppervlak omgezet in waterstof en zuurstof; de reactiechemie van deze omzetting is overigens hetzelfde voor fotokatalyse als elektrolyse. Vergeleken met waterstofvorming verloopt zuurstofvorming traag, waardoor de totale efficiëntie van waterstofproductie laag is. Daarom wordt veel onderzoek gedaan naar het begrijpen en versnellen van de zuurstofvorming, voor zowel elektrolytische als fotokatalytische processen.
De onderzoeksgroep Electrochemical Materials & Interfaces (EMI) van kennisinstituut DIFFER onderzoekt welke processen en materiaaleigenschappen ten grondslag liggen aan de traagheid van de zuurstofhalfreactie, om zo een (foto)anode te ontwikkelen voor een snellere zuurstofvorming. Wij doen dit door elektrochemische data te meten, te modeleren en te simuleren. Hierbij vindt een wisselwerking plaats. Experimentele data en bevindingen worden gebruikt om modellen nauwkeuriger te maken. Op hun beurt kunnen modellen en simulaties het gedrag van (foto)anoden voorspellen en daarmee de experimentele onderzoeker vertellen welke processen ten grondslag liggen aan de trage zuurstofvorming en welke eigenschappen en materialen leiden tot de hoogste efficiëntie. Zo versnellen we de voortgang van het onderzoek. In dit artikel zullen we twee voorbeelden van deze wisselwerking laten zien.
Hoe ziet het grensvlak er uit?
Wat we nog niet goed weten is via welke stappen het water in zuurstof wordt omgezet; waterstofvorming is ook nog niet geheel duidelijk, maar momenteel minder van belang omdat de trage zuurstofvorming limiterend is. Zoals in kader I is geschetst zijn twee watermoleculen (H2O) en vier gaten (h+) nodig om één zuurstofmolecuul (O2) te vormen. Dat vier gaten nodig zijn suggereert dat de oxidatiereactie bestaat uit minstens vier elementaire reacties. Een mogelijk reactieverloop in een zuur elektrolyt is geïllustreerd in Figuur 1. Hierin is te zien dat achtereenvolgens –OH, –O en –OOH aan het elektrode-oppervlak gevormd worden. Als we weten welke bindingen aan het oppervlak gevormd worden en waar dit op het oppervlak plaatsvindt (de zogenaamde katalytische plaats S), dan kunnen we het oppervlak bewerken (of maken) en een maximaal aantal katalytische plaatsen creëren.
Het is niet eenvoudig om dit experimenteel te meten. De tijdschaal waarop O2 gevormd wordt is relatief lang (0.1–1 seconde), maar sommige elementaire reacties gaan veel sneller (milliseconden-nanoseconden). Je moet dus erg snel kunnen meten. Wat het ook lastig maakt is dat de reactie plaatsvindt aan het grensvlak met water. Hierdoor zijn een aantal meettechnieken niet geschikt, omdat daarvoor bijvoorbeeld een vacuüm nodig is. Met infraroodspectroscopie is het wel gelukt om tussenproducten te meten. Door de foto-elektrochemische cel zodanig te ontwerpen dat de infraroodbundel niet (of nauwelijks) door het water gaat - water zou anders het infraroodlicht absorberen - zijn oxiden (S-O) en superoxiden (S-O-O-H) gemeten. Dit maakt het reactieverloop van Figuur 1 aannemelijk. Deze identificatie en kwantificatie van tussenproducten maken het modelleren van de reactie en het bepalen van de reactiesnelheden nauwkeuriger.
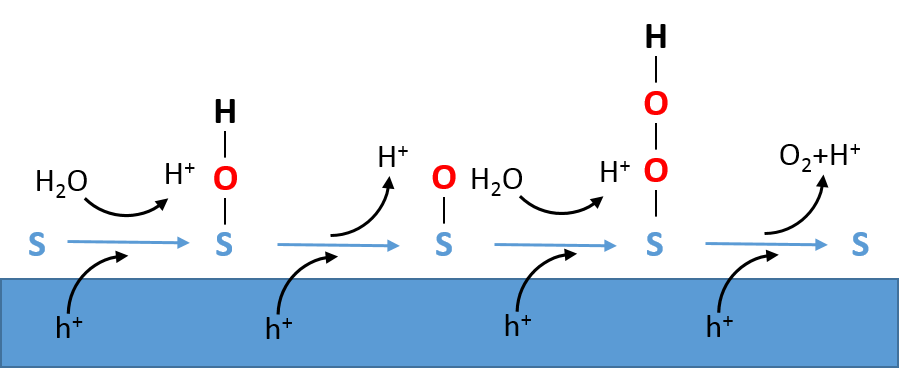
Achtereenvolgens worden –OH, -O en –OOH aan het oppervlak gevormd.
De protonen (H+) gaan via het elektrolyt naar de andere elektrode om daar waterstof (H2)
te vormen. In een basiselektrolyt worden mogelijk dezelfde oppervlakgroepen gevormd,
maar zal OH- (wat gevormd wordt aan de elektrode waar H2 geproduceerd wordt)
met het oppervlak reageren (zie ook kader I). [Aangepast van ref. [2]]
Aan de andere kant kunnen simulaties en modellen ook richting geven aan het experimentele onderzoek (zie kader II). Figuur 2a toont het experimenteel gemeten en gesimuleerde stroom-spanningsverloop van een hematiet (ijzeroxide) anode. Het gesimuleerde stroom-spanningsverloop is gebaseerd op een aantal aannames, zoals een perfect oppervlak, en een aantal benaderingen, het elektrolyt wordt beschouwd als een watergas en reacties vinden plaats in het donker. Bovendien weten we niet of het gebruikte reactieverloop (Figuur 1) juist is. Gezien deze verschillen is de overeenkomst tussen beide stroom-spanningsverlopen behoorlijk goed: de stroomdichtheden zijn van dezelfde ordegrootte en de aanvangspotentialen (zie kader III) zijn nagenoeg hetzelfde. Figuur 2b laat de gesimuleerde oppervlakdekking van de tussenproducten zien als functie van de aangelegde spanning. Volgens het model heb je de grootste kans om –OOH te meten wanneer je een spanning aanlegt tussen de 1.6-1.8 V vs. RHE (zie kader III). Het experimenteel meten van de oppervlakdekking als functie van de aangelegde spanning is erg moeilijk. Deze nieuwe wijze om dit te simuleren is een grote stap voorwaarts in het begrijpen van de zuurstofvorming.
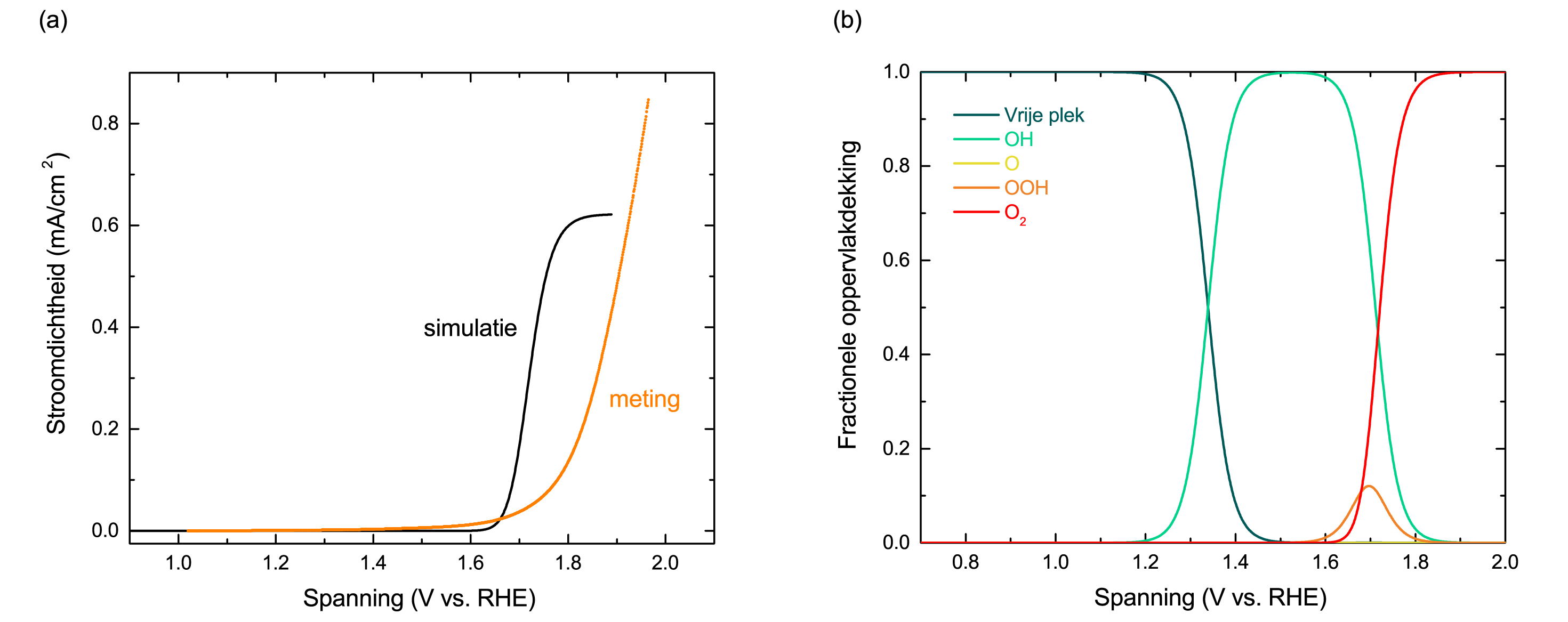
gesimuleerd met systeemtheorie. (b) Gesimuleerde oppervlakdekking van gevormde tussenproducten
op een ijzeroxide (hematiet) oppervlak als functie van de aangelegde spanning. De concentratie
van soort O is niet zichtbaar omdat de dekking klein is in vergelijking met andere soorten.
[Aangepast van ref. [3]]
Reactiesnelheid en andere processen Wat we ook nog niet weten is hoe snel de verschillende elementaire reacties lopen en welke andere processen een rol spelen. Zo kan naast ladingsoverdracht aan het grensvlak, ook elektron-gat recombinatie optreden en kan sprake zijn van vastzittende lading. Deze informatie zit opgesloten in de elektrochemische impedantie (zie kader III). Het meten van de elektrochemische impedantie is relatief eenvoudig, de interpretatie is echter zeer complex. Dat komt doordat een elektrisch equivalent systeem opgesteld moet worden en er geen verband is tussen de componenten van het elektrisch systeem en de verschillende elektrochemische processen. Door gebruik te maken van systeemtheorie (zie kader II) kunnen we elk effect op de impedantie afzonderlijk bekijken, zoals bijvoorbeeld de dichtheid van de vastzittende ladingsdragers of de effectiviteit van ladingsoverdracht. Hierdoor hebben we een directe verbinding van (elektro)chemische processen en impedantie.
Figuur 3a toont gemeten impedantiespectra van een hematiet anode voor verschillende potentialen. Het spectrum is opgebouwd uit twee halve cirkels. Dit geeft aan dat minstens twee processen een rol spelen. De grootte van de kleine halve cirkel laat nauwelijks een spanningsafhankelijkheid zien en beschrijft processen die plaatsvinden binnenin de anode, bijvoorbeeld elektron-gat recombinatie. De grootte van de grote halve cirkel is afhankelijk van de aangelegde spanning en beschrijft de ladingsoverdracht aan het grensvlak met het elektrolyt, m.a.w. de zuurstofvorming, welke afhankelijk is van de aangelegde spanning (Figuur 2a).
Met systeemtheorie gesimuleerde impedantiespectra zijn te zien in Figuur 3b. Hetzelfde verloop is te zien als de gemeten impedantie; de theorie beschrijft dus redelijk goed het gedrag van de anode. Ook hier zijn de gesimuleerde spectra volledig van de theorie afgeleid, terwijl experimentele metingen nooit ideaal zijn.
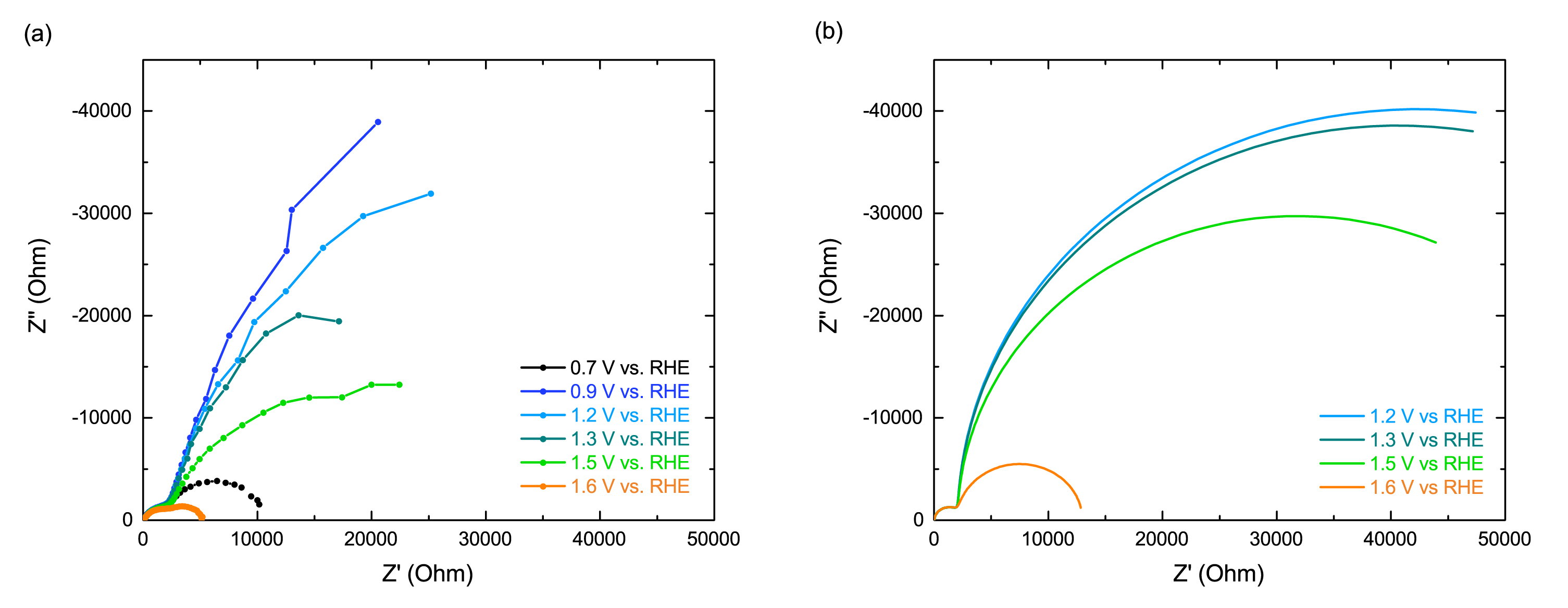
Voor de simulatie is aangenomen dat de zuurstofvorming verloopt zoals geïllustreerd in Figuur 1.
[Aangepast van ref. [3] en [4]]
Dus ook voor het begrijpen van de invloed van de verschillende processen op de efficiëntie van de zuurstofvorming is een goede wisselwerking tussen experimentele data, modellen en simulaties belangrijk. Voor een verbeterde overeenkomst tussen experimentele data en simulaties zullen belichting en diffusie moeten worden meegenomen in het model; ook moet rekening gehouden worden met niet-ideale oppervlakken. Anderzijds is ook identificatie en kwantificatie van tussenproducten nodig om een reactieverloop te valideren. Hiervoor werken we aan een opstelling om met infraroodlicht tussenproducten te meten als functie van de aangelegde spanning. Gezien de grote complexiteit en de mogelijkheid om deze methode ook voor andere elektrochemische systemen te gebruiken, zou dit onderzoek ons nog jaren bezig houden; elk nieuw inzicht brengt het onderzoeksveld vooruit, zodat we zo snel mogelijk waterstof direct van de zon kunnen maken.
Kader I - De werking van een foto-elektrochemische cel
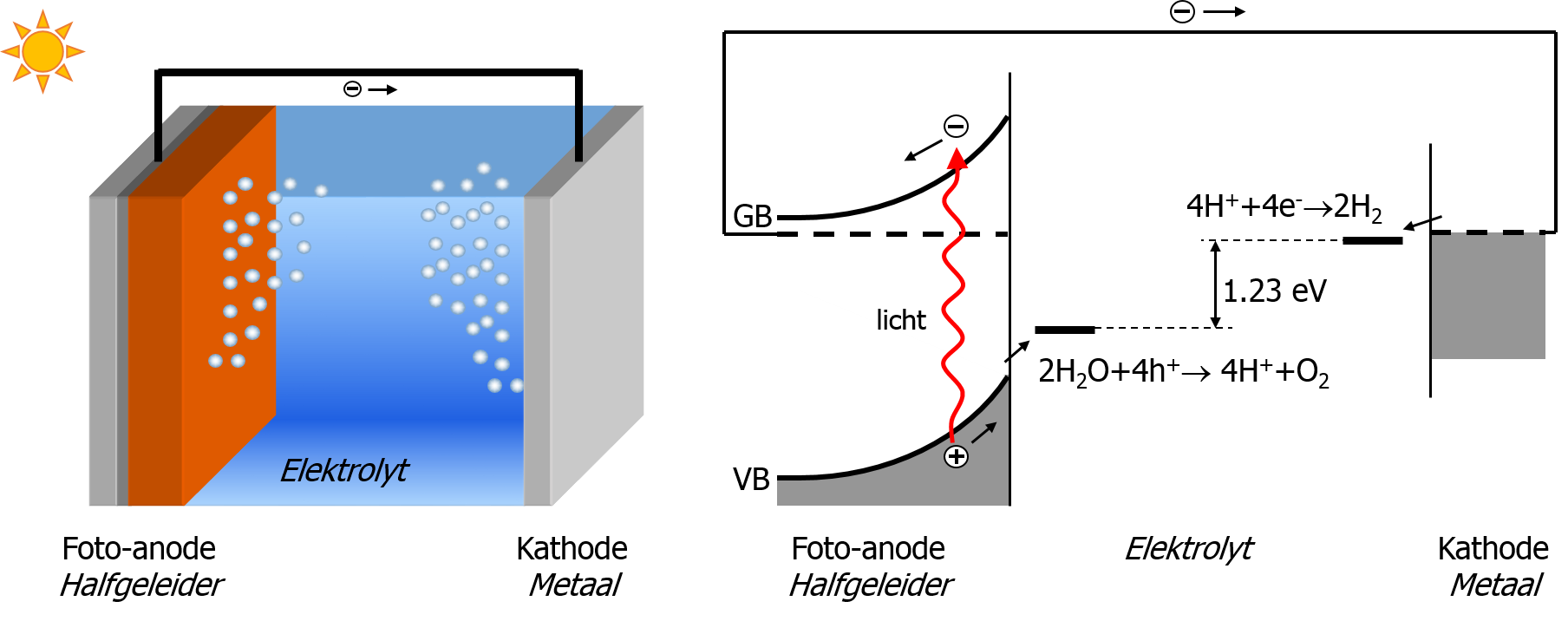
waar zuurstof wordt gevormd, en een metallische kathode, waar waterstof wordt gevormd.
(b) Het bijbehorende energiediagram voor gebruik van een zuur elektrolyt. (Aangepast van ref. [5])
Een foto-elektrochemische cel bestaat uit twee elektroden, typisch een halfgeleidende fotoanode en een metallische kathode, en het elektrolyt (Figuur 4). Het elektrolyt bestaat uit water waarvan de geleiding is verhoogd door toevoeging van zouten (bijv. KOH of NaOH) of zuren (zoals H2SO4). Wanneer licht op de halfgeleidende fotoanode valt, kan een elektron van de valentieband (VB) naar de geleidingsband (GB) gaan. De geleidingsband elektronen (e-) bewegen richting de kathode waar ze waterstof produceren. De gaten (h+) die achterblijven in de valentieband bewegen onder invloed van een ingebouwd elektrisch veld [*] naar het oppervlak waar ze gebruikt worden voor de productie van zuurstof. Afhankelijk van de zuurtegraad van het elektrolyt (pH) zullen de zuurstof- en waterstofhalfreacties verlopen volgens:
| Basen (pH > 7) | Zuren (pH < 7) | |
| Waterstofhalfreactie: | 2H2O + 4e- → 2H2 +4OH- | 4H+ + 4e- → 2H2 |
| Zuurstofhalfreactie: | 4OH- + 4h+ → 2H2O + O2 | 2H2O + 4h+ → 4H+ + O2 |
Aan de halfreacties is te zien dat “slechts” twee elektronen nodig zijn voor de productie van één waterstofmolecuul, terwijl er vier gaten nodig zijn voor de vorming van één zuurstofmolecuul. Vanwege de vier gaten is de vorming van zuurstof complexer dan de vorming van waterstof. De zuurstofvorming limiteert momenteel de totale efficiëntie van waterstofproductie. Daarom wordt veel onderzoek gedaan naar het begrijpen en versnellen van de zuurstofvorming.
[*] Zo’n ingebouwd elektrisch veld wordt veroorzaakt door ladingsoverdracht aan het halfgeleider/elektrolyt grensvlak, vergelijkbaar met de vorming van een pn-overgang.
Kader II - Modeleren en simuleren van fotokatalytische watersplitsing
In de EMI onderzoeksgroep gebruiken we voornamelijk dichtheidsfunctionaaltheorie (DFT) en systeemtheorie voor het begrijpen van de zuurstofhalfreactie. Met DFT kijken we vooral naar de elektronenstructuur en tussenproducten aan het elektrode-oppervlak (Figuur 5). Hiermee kunnen we bepalen voor welke elementaire reactie de meeste energie nodig is en hoeveel vrije energie in totaal nodig is om zuurstof te vormen. Het elektrode-oppervlak waar voor zuurstofvorming de minste energie nodig is, zal het meest geschikt zijn. Zo kunnen we snel en relatief eenvoudig een selectie maken van geschikte elektrodematerialen.
Met DFT kijken we naar de zuurstofvorming als thermodynamisch systeem. Om inzicht te krijgen in reactiesnelheden moeten we kijken naar de kinetische energie. Dit doen we met een nieuwe aanpak gebaseerd op systeemtheorie. Het model bestaat uit differentiaalvergelijkingen die de (elektro)chemische reacties beschrijven en massa- en ladingsbalansen. Deze zijn gekoppeld aan DFT berekeningen. Zo kunnen we onderzoeken wat de invloed is van de verschillende processen op de zuurstofvorming. We kunnen dezelfde data berekenen die we ook experimenteel meten (Figuur 2a en 3) alleen op basis van de chemische reacties. Bovendien kunnen we de oppervlakdekking als functie van de aangelegde potentiaal berekenen (Figuur 2b), iets wat lastig experimenteel te meten is.
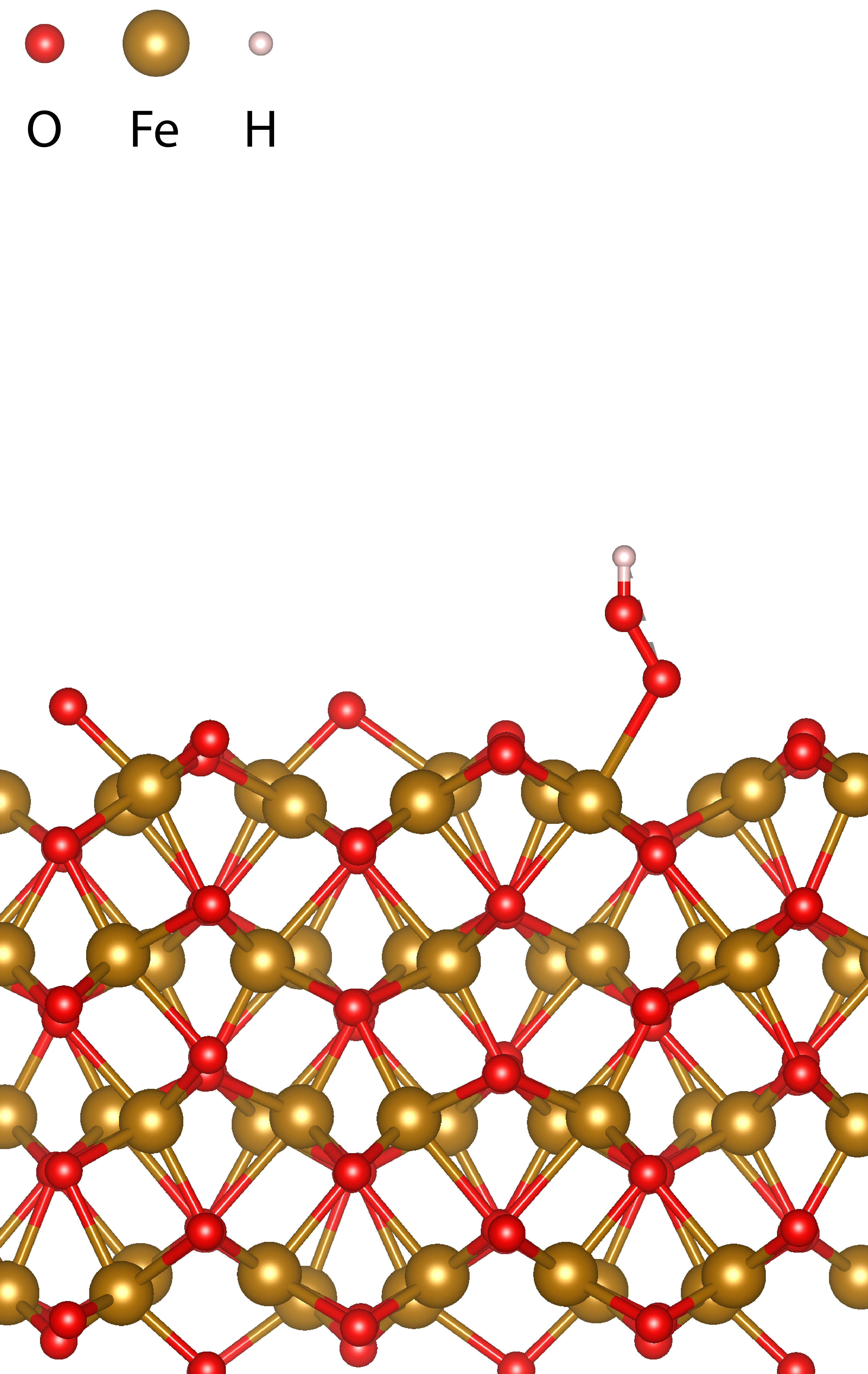
–OH vorming aan een hematiet oppervlak.[2]
KADER III - Elektrochemische meettechnieken
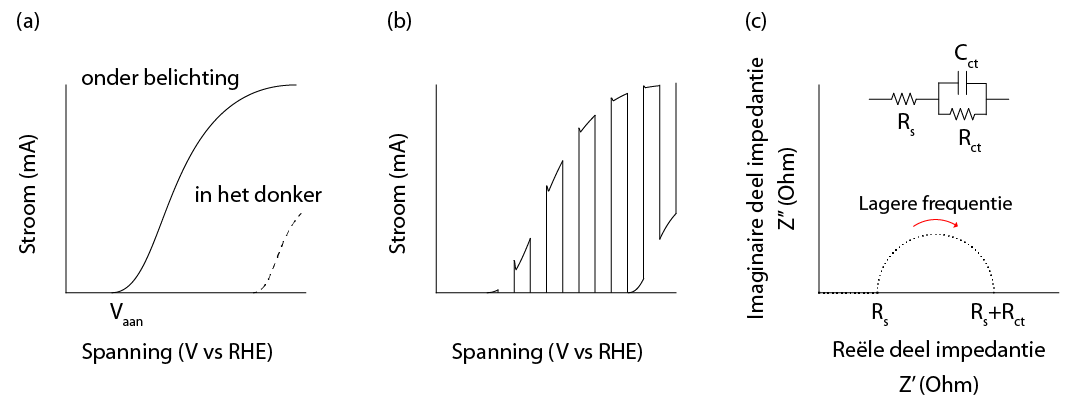
(b) een stroom-spanningscurve waarbij het licht afwisselend aan en uit gaat en
(c) een Nyquist grafiek en bijbehorend elektrisch equivalent systeem.
Voltammetrie
Het meten van de stroom bij een bepaald aangelegde spanning is een van de belangrijkste meettechnieken om de prestatie van een (foto)elektrode te bepalen (Figuur 6a en b). De spanning waarbij een stroom zal gaan lopen als gevolg van oxidatie van water heet de aanvangpotentiaal (Vaan). Thermodynamisch gezien is er 1.23 V vs. RHE nodig om zuurstof te vormen. RHE staat voor Reversible Hydrogen Electrode en is een veelgebruikt referentie-elektrode waarmee je eenvoudig verschillende experimenten met elkaar kan vergelijken. Door gebruik te maken van foto-elektroden kan zuurstof bij lagere aangelegde spanningen gebeuren (vanwege het fotovoltaïsche effect).
In werkelijkheid is Vaan hoger dan theoretisch gezien nodig is. Vaak komt dit door de aanwezigheid van defecten aan oppervlakken. De maximaal haalbare fotostroom is afhankelijk van de mate van licht absorptie (hoeveelheid vrijgemaakte elektronen en gaten) en geleiding (hoeveel elektronen en gaten bereiken ook daadwerkelijk het grensvlak met het elektrolyt).
Voltammetrie kan worden uitgevoerd in het donker (elektrochemie), onder belichting (foto-elektrochemie) en door het licht gedurende de meting alternerende aan en uit te doen (Figuur 6b). Deze laatste variant kan, aan de hand van de aan-/afwezigheid van pieken, inzicht geven of recombinatie van gaten en elektronen een rol speelt.
Elektrochemische impedantiespectroscopie (EIS)
Bij elektrochemische impedantiespectroscopie wordt een kleine (AC) verstoring aangebracht op de aangelegde spanning. Deze verstoring is terug te zien in de te meten stroom in de vorm van een faseverschuiving. De impedantie (Z) is de verhouding tussen de aangelegde spanning en de gemeten stroom. De impedantie kan geschreven worden als een complex getal. Door de frequentie van de verstoring te variëren, kun je bepaalde processen als het ware isoleren in het tijdsdomein. De impedantie wordt vaak weergegeven in de vorm van een zogenaamd Nyquist grafiek, waarbij het imaginaire deel van de impedantie (Z’’) geplot wordt als functie van het reële deel (Z’) (Figuur 6c). De curve heeft de vorm van een (of meerdere) halve cirkels. De impedantiedata wordt vervolgens beschreven met een elektrisch equivalent systeem. De meest gebruikelijke elementen zijn een weerstand (Z=R), welke bijvoorbeeld beschrijft hoe goed de ladingsoverdracht is aan een grensvlak, en een capaciteit (Z=1/jwC), welke bijvoorbeeld de mate van elektron-gat recombinatie of de dichtheid van vastzittende ladingsdragers weergeeft.
Referenties
[1] Jules Verne, Het geheimzinnige eiland (1874)
[2] Xueqing Zhang et al., Oxygen Evolution at Hematite Surfaces: The Impact of Structure and Oxygen Vacancies on Lowering the Overpotential, J. Phys. Chem. C 18201-18208 (2016)
[3] Kiran George et al., Integrated modeling of multistep reactions at photo-electrochemical interfaces using non-linear state-space model, To be published (2018)
[4] Rochan Sinha et al., Impact of thin film processing on the electrochemistry of hematite photoanodes, to be published (2018)
[5] Roel van de Krol, Photoelectrochemical Hydrogen Production, Springer (2012)
Biografie
Aafke Bronneberg promoveerde aan de faculteit Technische Natuurkunde van de Technische Universiteit Eindhoven op het gebied van plasma-depositie van dunne lagen voor zonnecellen. Daarna werkte zij als postdoc aan het Helmholtz-Zentrum Berlin waar zij met atoomlaagdepositie dunne lagen ontwikkelde ter verbetering van foto-elektroden. Momenteel werkt zij als Marie Curie fellow bij DIFFER aan een nieuwe opstelling om tussenproducten van de zuurstofhalfreactie te identificeren en te kwantificeren.
Anja Bieberle-Hütter leidt de onderzoeksgroep Electrochemical Materials and Interfaces (EMI) bij DIFFER. Ze behaalde haar diploma in Materials Science & Engineering aan de universiteit Erlangen-Nürnberg (Duitsland) en promoveerde aan de ETH in Zürich (Zwitserland). Hierna heeft zij achtereenvolgens twee jaar in de industrie gewerkt, als postdoc aan het MIT (VS) en als Oberassistent bij ETH. Haar werk combineert experimenten met modellering en simulaties, om de elektrochemische en materiaal gerelateerde beperkingen van elektrochemische grensvlakken te identificeren.
Dankwoord
Dit artikel is mede tot stand gekomen door de inbreng van Rochan Sinha, Kiran George en Xueqing Zhang. Zij hebben de experimenten en simulaties uitgevoerd.